【作者简介】 李荣荣,医师,硕士,Email:lirongrong1220@139.com
目的 为更近似地模拟细胞在体内所处的低氧环境,研制一种低氧控制装置,以实现对体外细胞培养氧气浓度的自动化控制。方法 体外细胞培养低氧控制装置由计算机控制的硬件和软件组成,硬件包括氧气控制与检测系统、氮气管路、细胞培养和抗干扰优化装置,软件是基于C语言的系统开发套件。当控氧仪经氧气传感器读取的氧气浓度值大于设定值时,氮气管路开放,氮气进入培养箱;当达到设定值时,氮气管路关闭,氮气不能通入,如此不断循环往复,从而使氧气浓度达到某一水平并维持稳定。通过将装置设定的氧气浓度与测氧仪测得的箱内实际氧气浓度进行比较及对氧气浓度达设定值后的波动情况进行监测,进一步验证装置的可行性。结果 体外细胞培养低氧控制装置设定的氧气浓度与测得的箱内实际氧气浓度差异无统计学意义(P>0.05),且该装置对设定值模拟的精度可达 ± 0.5%的要求,满足系统预定精度要求,并可保持较长时间稳定。结论 本装置能有效控制氧气浓度达所需要求,能满足在低氧条件下进行体外细胞培养的要求。
Objective To simulate the hypoxic environment of cells in vivo more approximately, a hypoxia control device which can control oxygen concentration automatically for cell culture in vitro was developed.Methods In vitro cell cultur e hypoxia control device consisted of hardware and software which were controlled by computer. The hardware was composed of oxygen detection and control system, nitrogen gas pipeline, cell culture and anti-jamming device, and the software was based on Clanguage. When oxygen controlle rreads the oxygen concent ration more than the set value, the nitrogen gas pipeline opens and nitrogen enter into the incubator; when reaching the set value, the nitrogen gas pipeline closes and nitrogen is not allowed to pass through. Circularly, a constant oxygen concentration was reached and maintained. This device was further verified by comparing the set value of the equipment with figures of the oxygen meter and by monitoring fluctuation condition after the oxygen concentration reaching the set value.Results There was no significant difference between the oxygen concentration set in the in vitro cell culture hypoxia control device and the actual oxygen concentration in the measured box ( P> 0.05), and the accuracy of the device to set the value of the simulation up to ± 0.5% of the requirements to meet the system accuracy requirements, and can remain stable for a long time.Conclusion The device can effectively control the oxygen concentration to the required requirements, to meet the conditions in the hypoxic conditions for in vitro cell culture.
氧是影响细胞存活和代谢的重要因素[1], 对细胞的增殖、分化、迁移和凋亡都有较大影响[2, 3, 4, 5, 6]。据研究机体内几乎所有组织系统都处于低氧环境中。动脉血氧浓度约为12%, 组织的平均氧浓度约为3%, 骨髓的氧浓度为1%~7%[7]。而目前国内外对细胞的体外培养及各种研究通常是在20%~21%的常氧条件下[8], 与体内多种细胞的氧张力环境有很大差异, 这一差异可能影响实验结果的精确性。有研究表明组织内氧浓度过高会增加氧自由基的产生从而对细胞造成损害[9]。而且, 模拟细胞生存的微环境对于离体细胞实验的意义正逐渐引起人们的重视, 模拟体内低氧环境进行细胞体外培养也受到越来越多的关注。培养细胞的缺氧研究, 使用能调节氧浓度的三气培养箱或缺氧培养小室[10, 11, 12]较为方便, 但由于其价格较高, 一般实验室并不具备, 多用化学试剂如去铁胺、氯化钴[13]模拟低氧环境或用有机玻璃[14]或真空干燥缸制成的简易缺氧小室[15, 16]代替。这些代替方法或不能精确控制氧气浓度或需定期校准手动调节, 使实验操作十分不便且对操作人员依赖性高, 使得进行长时间细胞实验时人力消耗过大。本研究的目的是模拟体内的低氧环境, 在已有装置的基础上研制一种体外细胞培养的自动化氧气控制装置。
CO2孵箱(MCO-15AC, 三洋公司, 日本), 含氮气的氮气钢瓶(济南德洋特种气体公司), 氮气减压表(青岛华青集团有限公司), 硅胶管, 电磁阀(ZCT-1U, 浙江余姚通用电磁阀厂), 氧气传感器(青岛海特尔环保科技有限公司), 单片机(美国SILABS公司), 测氧仪(希玛AR8100)。
使用基于C语言程序的单片机嵌入式系统开发软件套件研制体外细胞培养低氧控制装置, 可以对氧气浓度进行可视调节。
1.2.1 体外细胞培养低氧控制装置的组成 体外细胞培养低氧控制装置由控氧仪、氮气管路和细胞培养箱组成(图1), 其中氮气管路由氮气钢瓶、氮气减压表、硅胶管、电磁阀组成。
控氧仪的组成及各组件功能详述:控氧仪(图2)能自动控制氧气的浓度, 连接氧气传感器, 同时自身带有一个继电器。当设定氧气的浓度后, 如3%, 空气中的氧气含量为21%, 控氧仪自身的继电器为闭合状态, 允许电流通过, 当氧气浓度到达设定值3%后, 控氧仪自身的继电器为断开状态, 不允许电流通过。
在氮气从钢瓶通过减压表进入培养箱的管路上安有一个电磁阀, 电磁阀引线接到控氧仪的继电器上。此电磁阀通电状态是打开的, 允许气体通过, 不通电状态是关闭的, 不允许气体通过。这样通过单片机控制继电器的通断即可控制电磁阀的开启或闭合从而控制是否向箱体内加入氮气。
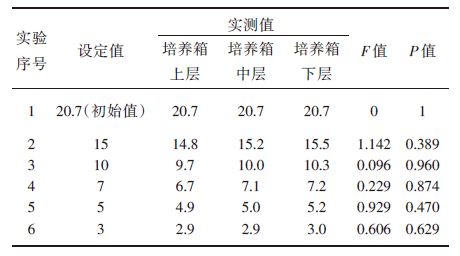
1.2.2 体外细胞培养低氧控制装置的测试 开启培养箱, 使温度及CO2浓度分别稳定于37 ℃与5%并达到培养箱预定的湿度, 实验过程中紧闭培养箱门。在培养箱上中下3层分别放置一个测氧仪, 设置控氧仪氧气浓度的上限分别为15%、10%、7%、5%、3%, 打开氮气瓶的阀门及控氧仪开关。当装置显示的氧气浓度达设定值时, 记录测氧仪测得的3个位置的实际氧气浓度, 并且此后每隔6 h记录装置所显示的氧浓度, 连续记录168 h。
利用GraphpadPtism 5 软件进行统计学分析, 单因素方差分析进行设定值、培养箱下层、培养箱中层、培养箱上层实测值的差异比较。
该装置运转后状态良好。细胞培养所需要的氧气浓度可通过改变控氧仪的数值进行调节。装置设定的氧气含量与3个位置所测得的氧气含量见表1。培养箱内3个位置的氧气浓度及设定的与实测的氧气浓度均无明显差异(P > 0.05), 且设定值模拟的控制精度可达 ± 0.5%的要求, 满足系统预定的精度要求。
| 表1 氧气浓度设定值模拟试验表 Table 1 The simulation date of set values of oxygen concentration (%) |
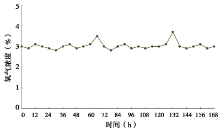
当氧气浓度达设定值后, 氧气浓度随时间波动的情况见图3(以设定值为3%为例)。多数观测时间点测得的氧气浓度刚好为设定值, 在设定值上下小范围浮动的数据能迅速回到设定值上, 随着系统对氧含量的不断调控使得系统能较长时间处于较为稳定的状态。后期由于氮气压力减弱, 氧气浓度不断升高:60 h氮气不足, 氧气浓度升高, 装置报警, 更换氮气瓶, 氧气浓度恢复至设定值, 126 h时氮气再次不足, 再次更换氮气瓶后, 氧气浓度再次恢复至设定值。
本实验装置的工作原理是使用基于单片机的自动化控制系统[17, 18], 通过负反馈的控制方式对氧气浓度进行调节。氮气管路一直是开启的, 当控氧仪经传感器读取的氧气浓度值大于设定值时, 控氧仪的继电器闭合, 允许电流通过, 则氮气管路上的电磁阀通电, 电磁阀为打开状态允许氮气通过; 当控氧仪读取的氧气浓度值达到设定值时, 控氧仪的继电器断开, 不允许电流通过, 则氮气管路上的电磁阀不通电, 电磁阀关闭不允许氮气通过。一段时间后, 氧气浓度升高, 又超过设定值时, 控氧仪的继电器又会闭合, 允许电流通过, 则氮气管路上的电磁阀又通电, 电磁阀又为打开状态允许氮气通过, 本循环不断往复, 从而达到维持一个恒定氧气浓度值的目的。
本装置中氧气传感器的选择十分重要, 其性能的优劣对氧气含量测控功能的实现及测控的精度有着直接的影响[19]。实验者可根据自己的实验条件及所需要的精度选择适合的氧气传感器。其次, 在模拟氧气浓度的设定值之前, 可先对控氧仪进行校准。打开控氧仪并敞开培养箱门, 使箱内外空气充分相通, 观察装置上显示的氧气含量值, 如没有其他更为精确的测量仪器对此时的空气含量进行测量, 则一般以空气中的氧气含量21%为标准进行校准。在对氧气浓度设定值的模拟精度测试中, 结果显示培养箱上中下3个位置上氧气浓度有所差异, 下方氧气浓度稍大。笔者认为由于氮气较氧气轻, 又在较偏上的位置进入培养箱, 且排气孔在培养箱的下方, 这可能是导致该结果的原因。不过, 鉴于此差异较小, 不会对实验造成太大影响。此外还需注意, 实验时要根据情况对氮气的压力进行调节, 调节范围为0.01~0.25 MPa。
同国内外已有的设备[13, 16, 20, 21]相比, 该装置具有操作简单、可自动控制、成本低、工作时间较长等优点, 极大地减轻了实验人员的劳动负担, 使实验操作更为方便, 适宜推广应用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|