【作者简介】 孙先阁,主治医师,硕士,Email:sunxiange123@163.com
目的 检测鼻咽癌放疗患者血清中不同放疗时段α2⁃巨球蛋白含量 ,了解其变化规律,探讨其作为反映放疗损伤的血清标志物的可行性。方法 采集23例鼻咽癌初诊患者在单纯放疗前、放疗10、20、30、33次5个时段的血标本,检测α2⁃巨球蛋白水平。采用SPSS17.0软件包,以配对t检验分析5个时段血清α2⁃巨球蛋白水平差异。结果 患者血清中α2⁃巨球蛋白水平随放疗次数增加而升高。放疗10次后鼻咽癌患者的血清α2⁃巨球蛋白浓度(12.04 ± 5.72) U/L高于放疗前(10.81 ± 5.38) U/L,差异具有统计学意义(t=-4.818,P < 0.05);放疗20次后鼻咽癌患者的血清α2⁃巨球蛋白浓度(12.26 ± 5.77) U/L高于放疗前,差异具有统计学意义(t=5.237,P < 0.001);放疗30次后鼻咽癌患者的血清α2⁃巨球蛋白浓度(12.91 ± 5.55) U/L高于放疗前,差异具有统计学意义(t=6.076,P < 0.05);放疗结束时鼻咽癌患者的血清α2⁃巨球蛋白浓度13.43 ± 6.05 U/L高于放疗前,差异具有统计学意义(t=5. 189,P < 0.05)。结论 放射治疗可引起血清α2⁃巨球蛋白改变,α2⁃巨球蛋白可成为反映颌骨电离辐射损伤的血清标志物。
Objective To investigate the changes of α2-macroglobulin in different stages of radiotherapy in patients with nasopharyngeal carcinoma, and to explore its feasibility as a marker of serum markers reflecting radiotherapy injury.Methods We collected the blood samples of 23 cases of newly diagnosed patients with nasopharyngeal carcinoma before the simple radiotherapy, the 10, 20, 30 and 33 times after simple radiotherapy, detected the α2- macroglobulin levels. The difference among the five stages was analysed by paired t-test using SPSS17.0 software package.Results The serum level of α2- macroglobulin elevated with the increase of number of radiotherapy. After 10 times’ radiotherapy, the serum α2-MG concentration in patients with nasopharyngeal carcinoma was significantly higher than that before radiotherapy (12.04 ± 5.72 vs. 10.81 ± 5.38 U/L), the difference was statistically significant ( t=4.818, P < 0.05). After 20 times’ radiotherapy, the serum α2-MG concentration in patients with nasopharyngeal carcinoma was significantly higher than that before radiotherapy (12.26 ± 5.77 vs. 10.81 ± 5.38 U/L), and the difference was statistically significant ( t=5.237, P < 0.001). After 30 times’ radiotherapy, the serum α2-MG concentration in patients with nasopharyngeal carcinoma was significantly higher than that before radiotherapy (12.91 ± 5.55 vs. 10.81 ± 5.38 U/L), the difference was statistically significant ( t=6.076, P < 0.05). At the end of radiotherapy, the serum α2-MG concentration in nasopharyngeal carcinoma patients was significantly (13.43 ± 6.05 vs. 10.81 ± 5.38 U/L) higher than that before radiotherapy ( t=5.189, P < 0.05).Conclusion The serum level of α2- macroglobulin changes with the radiotherapy, so it can be a serum marker reflecting the damage of maxilla induced by ionizing radiation.
放射性颌骨坏死(Osteoradionecrosis of the Jaws, ORNJ)是鼻咽癌放射治疗后的严重并发症, 其严重程度与放射剂量有关[1]。研究表明, 电离辐射引起的骨代谢特异性生化指标的改变, 这种改变能够在血清中得到较好的反映[2]。鼻咽癌放疗患者发生ORNJ患者与未发生ORNJ患者血清蛋白质谱的差异表达研究中寻找到包括α 2-巨球蛋白(α 2-macroglobulin, α 2-MG)和玻连蛋白等差异蛋白[3]。研究表明α 2-MG与ORNJ密切相关, 参与ORNJ骨代谢失衡的发生、发展[4] 。在鼻咽癌放疗后发生ORNJ及未发生ORNJ的患者进行高通量蛋白筛查与鉴定的研究中, 发现α 2-巨球蛋白与ORNJ骨代谢密切相关[5]。骨代谢的指标可以充分说明骨组织细胞功能发生的变化[6]。为进一步探讨α 2-巨球蛋白是否对骨组织的电离辐射具有保护作用, 本研究收集2015年2月~2016年2月间中山大学附属第五医院肿瘤放疗科收治的23名鼻咽癌患者, 分别检测放疗前、放疗10、20、30、33次后的α 2-MG血清指标进行检测分析, 了解其放疗过程中动态改变, 现报道如下。
2015年2月~2016年2月间, 在中山大学附属第五医院肿瘤放疗科首次就诊的患者中, 选择临床病理确诊为鼻咽癌, 并且患者病灶及全身状况符合纳入标准的病例23例, 其中男性14例, 女9例, 年龄为40~65岁。所有患者适合并愿意接受国际抗癌联盟(Internation Union Against Cancer, UICC)的规范化鼻咽癌放疗方案。
1.2.1病例纳入标准
经鼻咽部病理活检确诊为鼻咽癌患者, 影像学检查肿瘤病变未侵犯骨组织, 无骨转移及远处转移, 患者适合并愿意接受UICC(2002)的规范化放疗。具体方案为:适行调强放疗, 70 Gy/33次, 2.12 Gy/次, 7周。详细询问患者现病史、既往史、婚育史、家族史, 排除患有糖尿病、甲状腺和甲状旁腺功能改变、肝肾功能不全、骨折、骨折疏松、骨发育不良及各种遗传性骨病等影响骨代谢的全身性疾病; 患者放疗前半年内未服用激素、降钙素、钙片、双磷酸盐、氟化物等影响骨代谢的药物; 患者签署知情同意书。
1.2.2. 标本采集及处理
留取入组病例5个时段的血标本:患者接受放疗前、放疗后10、20、30、33次的血液标本, 取清晨(7:00am)空腹静脉血5 mL, 置于不抗凝无菌试管中, 室温下静止30 min, 以3 000 r/min的速度离心10 min, 吸取上层血清, 分装于无菌EP管, 并做好标记, 置于-80 ℃冰箱保存待测α 2-MG 。
1.2.3 标本检测
血清α 2-MG水平采用酶联免疫吸附法统一测定。试剂盒购自上海远慕试剂公司, 严格按照试剂盒的说明操作。在主波长405 nm、次波长600 nm的酶标仪上测得标准品、质控品和各标本的吸光度值(A405nm), 将标准品的浓度和测得标准品的A405nm值输入计算机作回归分析, 以标准品的A405nm值为纵坐标、标准品的浓度为横坐标, 绘制出标准曲线, 得出两者的相关方程, 根据方程、质控品及标本的A405nm值计算出各质控液、标本的浓度。
以Excel 2003建立数据库, 采用SPSS 17.0软件包进行数据分析; α 2-MG水平采用组间配对计量资料行t检验, P< 0.05为差异有统计学意义。
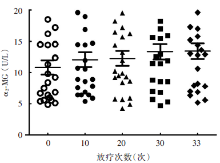
放疗前鼻咽癌患者血清α 2-MG浓度为10.81 ± 5.38 U/L, 放疗10次后浓度升为12.04 ± 5.72 U/L, 较放疗前升高, 差异具有统计学意义(t=4.818, P < 0.05); 放疗20次后, 血清α 2-MG浓度为12.26 ± 5.77 U/L, 较放疗前升高, 差异有统计学意义(t=5.237, P < 0.001)。放疗30次后, 血清α 2-MG浓度为12.91 ± 5.55 U/L, 较放疗前升高, 差异有统计学意义(t=6.076, P < 0.05)。放疗结束时, 鼻咽癌患者血清α 2-MG浓度达到13.43 ± 6.05 U/L, 较放射治疗前明显升高, 差异具有统计学意义(t=5.189, P < 0.05)(图1)。
组间比较, 可见放疗第10次结束后与第20次后血清α 2-MG浓度的差异不明显, 差异不具有统计学意义(t=5.237, P=0.198)。放疗第10次结束后与第30次后血清α 2-MG浓度的差异具有统计学意义(t=3.412, P=0.004)。放疗第10次结束后与第33次后血清α 2-MG浓度的差异具有统计学意义(t=2.955, P=0.009)。放疗第20次结束后与第30次后血清α 2-MG浓度的差异具有统计学意义(t=3.605, P=0.002)。放疗第20次结束后与第33次后血清α 2-MG浓度的差异具有统计学意义(t=2.807, P=0.013)。放疗第30次结束后与第33次后血清α 2-MG浓度的差异不明显, 差异不具有统计学意义(t=0.063, P=0.951)。
α 2-MG是血浆中相对分子量最大的蛋白质, 相对分子量约为65.2~80万, 含糖量约8%[7]。由4个亚单位组成, 4聚体是有2个二聚体通过非共价键连接形成。α 2-MG最突出的特性是能与多种分子和离子结合, 特别是能与丝氨酸、巯基、羧基蛋白水解酶和一些金属蛋白水解酶等不少蛋白水解酶结合而影响这些酶的活性[8]。α 2-MG与蛋白水解酶相互作用可使α 2-MG的分子构象发生变化。由于α 2-MG分子构象易发生改变使其能够与骨形成蛋白酶1、抗酒石酸酸性磷酸酶、血管内皮生长因子等发生结合[9, 10, 11], 会导致其生物活性改变, 从而在骨代谢中具有极其重要作用。
本研究发现鼻咽癌患者血清中α 2-MG浓度在放疗前水平为10.81 ± 5.38 U/L, 放疗33次时达到13.43 ± 6.05 U/L, 放疗后与放疗前比较α 2-MG水平随着放射次数增大而逐步增加。但是我们研究发现放疗20次与10次的α 2-MG含量变化是不明显的, 放疗33次与30次的α 2-MG含量变化也是不明显的。 研究发现[12]在照射剂量为5~10 Gy前加入人血α 2-MG制剂能够有效抑制辐射引起的多形核白细胞释放氧自由基量的增加并提高红细胞中超氧化物歧化酶活力。当照射剂量为20 Gy时, α 2-MG制剂可以抑制多形核白细胞释放氧自由基, 研究证实α 2-MG的抗辐射机制可能与抑制过多的氧自由基有关。实验还发现[12]正常血液中加入人血α 2-MG制剂后, 血浆组织蛋白酶D活力、多形核白细胞释放氧自由基量及红细胞中SOD活力都不受影响, α 2-MG能与蛋白酶结合而降低蛋白酶活力, 有利于保护细胞组织[13]。α 2-MG不仅抑制组织蛋白酶D, 而且能减少PMN氧自由基的生成。也有研究表明α 2-MG对放射后组织产生的保护作用主要是通过抗氧化, 抗纤维化, 抗炎和提高DNA修复[14]。α 2-MG抑制因辐射引起过多氧自由基的释放与其抑制组织蛋白酶D有关。一定辐射剂量范围内早期给予α 2-MG的治疗, 可以减少电离辐射引起的蛋白酶增加, 从而抑制过多氧自由基的释放, 可能有助于终止氧自由基与蛋白水解酶的作用, 有助于损伤修复; α 2-MG对放疗后组织具有保护作用[15]。
头颈部肿瘤放射治疗引起的ORNJ病因多年来一直崇尚血管栓塞学说[16], 即放疗区域骨组织周围的血管因电离辐射栓塞后造成血管狭窄和闭塞导致血供锐减和终止, 引起局部组织营养障碍。但近年研究证实颌骨放射性损害主要是射线对骨细胞的直接损害[17]和对骨显微硬度造成影响[18], 而不是由于局部血管闭塞导致的血循环障碍的并发症。也有学者认为放射性骨损害与血管损害是互为因果, 互为关联的, 最终导致ORNJ的发生[19]。Delanian[20] 提出以纤维变为核心的新ORNJ发病机制学说, 认为ORNJ发生分为3个阶段, 第一阶段单态氧的产生, 第二阶段单态氧介导下, 肿瘤坏死因子A、纤维母细胞生长因子B、转化生长因子β 1等细胞因子的释放致纤维母细胞的异常激活, 第三阶段为骨组织的代谢和自身调节产生障碍。α 2-MG诱导蛋白及细胞因子的相互作用是电离辐射保护的基础, α 2-MG是自然辐射保护的主要效应器[21]。电离辐射对组织细胞的损伤机理, 一方面除了直接损伤大分子外, 另一方面很重要就是产生活性氧, 产生氧自由基[22], 而α 2-MG具有天然氧自由基清道夫的作用并上调过氧化氢酶的活性[23]。内源性细胞内抗氧化酶水平对于人体天然的细胞辐射抗性起重要作用, 抗氧化酶(如超氧化物歧化酶)的活性是抑制ROS 水平的第一道防御线。本实验中随着放射次数的增加, 电离辐射对机体损伤的加重, 血清中α 2-MG含量逐渐增加, 这表明机体通过不断分泌α 2-MG来修复放疗损伤。因此, α 2-MG是反应电离辐射损伤的重要血清标志物。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|