作者简介:郑翼,主治医师,博士,Email:drzhengyi@163.com

通信作者简介:刘楚峰,医学博士,主任医师,硕士生导师,现工作于南方医科大学口腔医院正畸科。美国正畸TWEED 基金会会员;中国Tweed中心教官;美国佐治亚大学牙学院访问学者;国际正畸联盟(WFO)会员;中华口腔正畸学会会员;广东省口腔医学会口腔正畸学专业委员会委员;《口腔疾病防治》、《实用医学杂志》审稿专家。主持和参与国家级、省级科研基金项目6 项,并在国内外正畸专业权威期刊发表论文20 余篇,其中SCI收录5篇。
目的 研究正畸力加力后大鼠前扣带皮质层信号转导与转录激活因子1(STAT1)表达水平的变化规律,以探讨STAT1及其所在的JAK-STAT1信号通路在正畸牙移动疼痛中的介导和调控作用。方法 将112只8周龄体质量(225 ± 25)g雄性SD大鼠随机分为实验组(96只)和对照组(16只)。将实验组又分为4 h组、12 h组、24 h组、2 d组、3 d组、7 d组,每组各16只。实验组和对照组均采用镍钛拉簧在双侧上颌建立大鼠正畸牙移动模型,实验组双侧均施加80 g正畸力;对照组仅安装相同正畸装置,但不施加正畸力。加力后4 h、12 h、24 h、2 d、3 d、7 d分别取不同组别大鼠大脑前扣带回皮质组织,应用免疫荧光染色法和实时荧光定量PCR法进行研究。结果 对照组与实验组6个亚组之间的STAT1及p-STAT1相对表达量差异均有统计学意义;与对照组相比,STAT1表达量在加力4 h时降低 (P < 0.05);至加力2 d时,差异仍有统计学意义( P < 0.01)。4 h组、12 h组、24 h组相对表达量明显低于3 d组和7 d组,差异均有统计学意义( P < 0.05);2 d组明显低于7 d组,差异有统计学意义( P < 0.05)。对照组与实验组之间的p-STAT1表达量差异均有统计学意义;对照组表达量低于不同时间组;4 h组表达量明显低于12 h组和24 h组,但高于2 d组、3 d组和7 d组;12 h组表达量低于24 h组,但高于2 d组、3 d组和7 d组,2 d组高于3 d组和7 d组,3 d组高于7 d组,差异均有统计学意义( P < 0.05)。在STAT1 mRNA表达量上,4 h、12 h、24 h、2 d、3 d、7 d的对照组与实验组的两两比较结果均无统计学差异( P> 0.05)。结论 正畸力作用下,大鼠前扣带皮质层中STAT1表达水平一过性降低,p-STAT1表达水平一过性升高。推测正畸疼痛的产生可能与前扣带皮质层STAT1活化为p-STAT1有关。
Objective To study the change of STAT1 expression in the anterior cingulate cortex on rats under orthodontic force, and to further explore the roles of STAT1 and related JAK-STAT1 signaling pathway in the mediation and regulation of pain during tooth movement.Methods 112 male Sprague-Dawley (SD) rats (225±25 g) were used in this study. They were randomly divided into experimental groups (96 rats) and control groups (16 rats). All rats were installed bilateral maxillary device for tooth movement models. Rats in the experimental groups were applied 80g orthodontic force on both sides and were divided into six subgroup 4 h, 12 h, 24 h, 2 d, 3 d, 7 d, with 16 rabbits in each subgroup. The control groups were only installed the same orthodontic devices, without the application of orthodontic force. Brain tissue of the anterior cingulate cortex was isolated after 4 h, 12 h, 24 h, 2 d, 3 d, 7 d since experiment, and the expression level of STAT1 and p-STAT1 was analyzed with the method of immunofluorescence and PCR.Results For the immunofluorescence result, there was significant difference in STAT1 expression between control groups and different experimental groups at different time points in total ( P < 0.05). The STAT1 expression amount in the 4 h group decreased significantly when compared with the control group ( P < 0.05); to the 2 d group, the difference is still statistically significant ( P < 0.01). 3 d group, 7 d group and control group had no statistically significant difference. The STAT1 expression amount in 4 h group, 12 h group, 24 h group was significantly lower than that in 3 d and 7 d groups, differences were statistically significant ( P < 0.05). The STAT1 expression in the 2 d group was significantly lower than that of 7 d (42.35 ± 5.77) group, the difference was statistically significant ( P < 0.05). There was significant difference in p-STAT1 expression between control groups and different experimental groups at different time points in total ( F= 623.518, P < 0.05). The p-STAT1 expression amount in experimental groups were higher than that in the control group ( P < 0.05). The p-STAT1 expression in 4 h group was lower than that in 12 h and 24 h group and higher than that in 2 d, 3 d and 7 d groups, of which the differences were statistically significant ( P < 0.05). The p-STAT1 expression in 12 h group was lower than that in 24 h group and higher than that in 2 d, 3 d and 7 d groups, of which the differences were statistically significant ( P < 0.05). For the PCR result, the expression of mRNA in STAT1 of experimental groups of 4 h, 12 h, 24 h, 2 d, 3 d, 7 d and the control groups were not statistically significant ( P> 0.05).Conclusions After applying orthodontic force, the expression of STAT1 decreased transiently and the expression of p-STAT1 increased transiently. The reduction of STAT1 was probably caused by the phosphorylation of STAT1 and decrease in the translation level of STAT1, rather than changes in the transcriptional levels. The orthodontic pain might be related with the activation of STAT1 into phosphorylated STAT1.
近年来, 有关正畸疼痛机制的研究日益受到关注, 以往研究主要集中在外周神经系统, 中枢水平较少。前扣带皮质层(ACC)介导痛觉的情感部分, 该区与痛觉的形成、编码、调制都有密切关系[1]。Janus激酶-信号转导与转录激活因子通路(JAK-STAT)是细胞因子发挥作用时, 最直接也是最重要的信号转导途径[2], 它与疼痛的介导有密切的关系。IL-6和STAT3的活化是引起慢性疼痛和类风湿性关节炎的关节损伤的主要介质因子[3]。IL-12、IL-18的促疼痛作用也是通过JAK-STAT通路的STAT4介导的[4]。本课题组前期实验发现ACC区蛋白激酶Mζ (PKMζ )表达水平的升高可能与正畸疼痛有关[5]; 通过蛋白质组学筛查正畸加力后大鼠ACC区各种蛋白的表达差异, 发现变化较为明显的信号通路分子为STAT1[6]。为进一步研究STAT1在正畸牙移动疼痛中的作用, 本研究采用免疫荧光染色法和实时荧光定量PCR的方法, 研究在正畸力作用下STAT1和p-STAT1(磷酸化STAT1)在大鼠前扣带皮质层中的表达情况, 进一步从中枢水平探究正畸牙疼痛的机制。
选用成年雄性SD大鼠112只, 体质量(225 ± 25)g, 中山大学实验动物中心提供(动物合格证号:4400850000)。 饲养于SPF级屏障环境下, 23~25 ℃, 12 h日/12 h夜循环, 动物自由进食。实验大鼠口内均安置正畸加力装置, 用随机数表法将实验大鼠随机分为对照组(16只)和实验组(96只), (实验组:4 h组、12 h组、24 h组、2 d组、3 d组、7 d组), 每组16只(分别用于免疫荧光检测和实时荧光定量PCR)。实验组每侧施加80 g的矫治力, 对照组不加力。
将实验大鼠用3%戊巴比妥(40 mg/kg)腹腔注射麻醉, 上中切牙的唇面和轴角近颈处磨出固位沟并8字结扎, 用结扎丝将镍钛拉簧固定于上颌第一磨牙和切牙之间, 粘接剂加固结扎丝。实验组双侧均用测力计测出80 g的矫治力, 对照组不加力[7]。实验后当天起, 软食喂养。每天检查装置, 发现脱落及时安装。
ACC区组织制备 在预设的时间点, 实验大鼠用戊巴比妥腹腔内注射麻醉, 自胸骨中线至下颌切开, 分离各层组织后, 暴露心脏。经右心房用大注射器装入4 ℃的生理盐水连续快速灌注约2~3 min直至肝脏呈白色。在枕骨大孔处横断颅顶骨并剪开, 分开两侧顶骨, 暴露大脑。参照《大鼠脑立体定位图谱》, 大鼠脑立体定位仪辅助定位下, 冠状切开大鼠大脑, 切取前囟3.7~-1.4 mm ACC区的脑组织, 液氮中速冻, -80 ℃ 保存。
测用冰冻切片机切成厚度约4 μ m的切片, 冷丙酮固定、冲洗、微波炉中低火5 min抗原修复、冲洗、组化笔画圈、3%牛血清白蛋白封闭、滴加STAT1和p-STAT1一抗4 ℃孵育过夜、冲洗、滴加二抗室温孵育50 min、DAPI染液复染细胞核、冲洗、抗荧光淬灭封片剂封片、尼康倒置荧光显微镜下观察并采集图像。按等距抽样原则, 每张切片中随机选择出3个视野, 导入Image-Pro Plus 6.0软件。设好测量参数, 矫正光密度, 得出每张照片中阳性的累积光密度值(Integral optical density, IOD)。
实时荧光定量PCR检测STAT1的mRNA水平 将ACC区组织块装入已经装有1 mL的Trizol试剂(Invitrogen, 美国)的无酶1.5 mL离心管中。用Fast Prep仪(MP, 美国)将组织磨碎、匀浆, 提取总RNA。用实时荧光定量PCR仪(Life technologies, 美国)逆转录合成cDNA。
每个样本做3个复管, 用绿色荧光定量系统(Life technologies, 美国)对STAT1基因及内参β -actin进行实时荧光定量PCR扩增。引物序列见表1。反应条件为:95 ℃(2 min), 然后以95 ℃(10 s), 60 ℃(30 s)和72 ℃(30 s), 进行45个循环。采用相对定量的 2-Δ Δ Ct 法进行分析。
| 表1 STAT1和β -actin的引物序列 Table 1 Primer sequences of STAT1 and β -actin |
应用SPSS 16.0软件进行统计学分析。STAT1和p-STAT1的IOD值和STAT1的相对表达量用x ± s的形式表示。总体比较用单因素方差分析法(F检验), 各组别间的多重比较用LSD-t检验法, P < 0.05为差异有统计学意义。
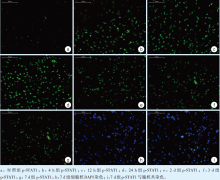
2.1.1STAT1的免疫荧光染色结果对照组阳性染色细胞多, 荧光强度较强, 胞核染色均一, STAT1较多分布于细胞质中(图1a~c)。4 h组、12 h组、24 h组的荧光强度减弱(图1d~f)。2 d组、3 d组、7 d组荧光强度渐增, 7 d组基本恢复至对照组水平(图1g~i)。
 | 图1 对照组与实验组中STAT1的表达情况(免疫荧光染色 × 200)Figure 1 STAT1 expression in control and experimental group(Immunofluorescence × 200) |
STAT1的IOD值分析结果(表2):对照组与实验组6个亚组之间的STAT1的IOD值间的差异均有统计学意义(F=5.314, P < 0.05)。对照组IOD值明显高于4 h组、12 h组、24 h组、2 d组; 4 h组、12 h组、24 h组明显低于3 d组和7 d组; 2 d组明显低于7 d组, 差异均有统计学意义(P < 0.05)。4 h组、12 h组、24 h组、2 d组间差异无统计学意义。
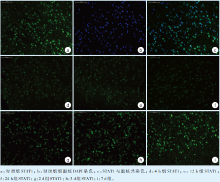
STAT1荧光强度较弱(图2a), 4 h组、12 h组、24 h组的荧光强度明显增强(图2b ~ d)。2 d组、3 d组、7 d组荧光强度较24 h组逐渐下降, 仍强于对照组(图2e ~ g)。细胞核染色均一, p-STAT1染色基本均位于细胞核内(以7 d组示, 图2h ~ i)。
| 表2 不同时间实验组STAT1相对表达量的差异比较 Table 2 Comparison of STAT1 expression of different experimental groups( |
p-STAT1的IOD值分析结果(表3):对照组与不同时间实验组STAT1的IOD值间的总体差异有统计学意义(F=623.518, P < 0.001)。对照组IOD值明显低于各实验组; 4 h组明显低于12 h组和24 h组, 但高于2 d组、3 d组和7 d组; 12 h组表达量明显低于24 h组, 明显高于2 d组、3 d组和7 d组; 2 d组明显高于3 d组和7 d组; 3 d组明显高于7 d组, 上述差异均有统计学意义(P < 0.05)。
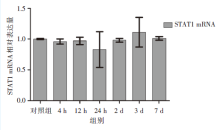
应用2-Δ Δ Ct法对STAT1 mRNA的表达量进行统计分析, 各时间点实验组的相对表达量与对照组的差异无统计学意义(P> 0.05), 见图3。
| 表3 对照组和不同时间实验组p-STAT1表达量的差异比较 Table 3 Comparison of STAT1 expression of control group and different experimental groups ( |
JAK-STAT信号通路的异常活化已经被证实与炎症、感染、癌症、自身免疫疾病、类风湿性关节炎、哮喘、糖尿病等有关。在疼痛的产生与调节中, JAK-STAT通路也有重要的信号传导作用[8]。STAT1的活化由特定细胞因子与细胞膜受体结合引发, JAK激酶发生自身磷酸化, 催化受体胞质链的特定位点发生酪氨酸磷酸化, 形成STAT的停泊位点, 通过与STAT分子的SH2区域的直接相互作用募集STAT蛋白[9, 10]。STAT蛋白与DNA结合与转录的活性需要STAT二聚化, 其二聚化由一个单体的磷酸化酪氨酸和另一个单体的SH2区相互作用而形成。STAT蛋白的细胞核细胞质循环频率可能决定了细胞因子传导的强度和作用时间[11]。
由于细胞核膜的屏障作用, 蛋白质及其他生物大分子选择性的进出细胞核。STAT1蛋白进出细胞核主要通过核膜上的核孔复合体和核转运蛋白的转运作用[12], 磷酸化STAT二聚体进入细胞核和去磷酸化STAT离开细胞核[11]。此外, 即使没有细胞因子的刺激, 非磷酸化STAT蛋白也可以通过非载体和非能量依赖的机制, 直接与核孔相互作用完成入核[11, 14]。
本实验中发现, 4 h、12 h、24 h时实验组大鼠ACC区p-STAT1蛋白的表达量与对照组相比均有明显升高, 这可能与施加正畸力后与疼痛有关的细胞因子激活STAT1蛋白, 活化为p-STAT1, 转入至细胞核有关。p-STAT1入核后, 与相关靶基因区段结合, 介导与疼痛有关的级联反应。p-STAT1蛋白表达水平至24 h达到最高值, 之后逐渐降低, 到7 d时基本恢复到与对照组相当的水平, 这与临床上正畸治疗患者的疼痛特点基本一致[15], 表明p-STAT1蛋白的表达水平与正畸疼痛的强度基本呈正相关关系。24 h后的降低可能与机体对正畸力反应逐渐减轻, 激活JAK-STAT1信号通路的炎症因子减少, 之前转入核的p-STAT1也通过去磷酸作用, 回到胞质中有关。
本实验中STAT1蛋白的表达水平在24 h最低, 之后逐渐回升, 到7 d时基本恢复到与对照组相当的水平, 而STAT1mRNA的水平无明显变化, 表明STAT1蛋白水平的变化不是STAT1转录水平的变化引起的, 而可能与STAT1翻译水平的变化及非载体、非能量依赖性的出入核途径有关。
正畸疼痛是正畸治疗常见不良反应的一种, 它直接地影响了正畸治疗的疗效和患者的配合情况, 因此疼痛控制是正畸治疗中非常重要的一部分[16]。现有的非甾体类抗炎药[17]、物理疗法[18]及心理疗法[19]有一定的作用, 也有一些局限性。因此完善对在中枢层面对正畸疼痛机制的认识, 开发更为精确、安全、高效的正畸治疗方式具有十分重要的意义的。在本研究中, 实验组大鼠在STAT1和p-STAT1表达量上与对照组有显著的差异, 说明了STAT1在牙移动疼痛的形成与维持中有调控作用, 它可能会成为未来正畸疼痛治疗的新靶点。
综上所述, 本实验通过建立大鼠正畸牙移动模型, 研究STAT1在大鼠前扣带皮质区中的表达变化情况, 探讨了JAK-STAT1通路在正畸牙移动疼痛中的作用, 提示STAT1及p-STAT1参与正畸疼痛的形成, 但STAT1总蛋白的变化机制尚需进一步的研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|