| 【作者简介】 袁林,教授,主任医师,硕士生导师。一直从事口腔医学的医、教、研工作,专业以口腔修复、口腔种植为主。现任广州医科大学研究生院副院长,广东省口腔医学会修复专业委员会副主任委员,中华医学会广州市医学会口腔医学分会副主任委员,国家自然科学基金委员会同行评议专家,广东省自然科学基金委员会同行评议专家,广州市科技专家库专家。广东省青年科学家协会常务理事。以第一作者或通讯作者发表科研论文45篇,参编专著5部。承担省部级课题6项。 |
目的 比较人不同来源骨髓间充质干细胞(human bone marrow mesenchymal stem cells,hBMSCs)的骨向分化能力,为骨组织工程筛选种子细胞提供一定的理论基础。方法 体外组织块培养法和有限稀释法培养颌骨来源骨髓间充质干细胞(jaw bone-marrow-derived mesenchymal stem cells,JMMSCs);骨髓穿刺法和密度梯度离心法培养长骨来源骨髓间充质干细胞(bone-marrow-derived mesenchymal stem cells,BMMSCs)。流式细胞仪鉴定细胞表面抗原标记,成骨分化诱导后茜素红染色检测细胞矿化能力,成骨分化诱导后qRT-PCR及Western Blot检测细胞成骨相关分子:Runx2、1型胶原(Collagen Type 1,COL-1)、OCN。结果 JMMSCs和BMMSCs均阳性表达CD90、CD105,阴性表达CD34、CD14、CD45。成骨分化诱导21 d后,茜素红染色显示JMMSCs矿化能力强于BMMSCs。成骨诱导7 d、14 d、21 d后,JMMSCs成骨相关分子在基因和蛋白水平上均强于BMMSCs。结论 与BMMSCs相比,JMMSCs成骨分化能力较强,颌骨骨髓可能更适于用作骨组织工程的成体干细胞来源。
Objective To compare the osteogenic differentiation abilities of human bone marrow mesenchymal stem cells (hBMSCs) from different sources, and to provide basis for choosing a new source of seed cells in bone tissue engineering.Methods Jaw bone-marrow-derived mesenchymal stem cells (JMMSCs) were isolated from orthognathic surgical sites and cultured by limited dilution for single cell clone. Long bone-marrow-derived mesenchymal stem cells (BMMSCs) were obtained from bone marrow of volunteers and isolated by density gradient centrifugation method. Flow cytometry was used to detect the surface markers of both cells. Osteogenic ability was assessed by PCR and Western Blot after osteogenic differentiation for the following molecules: Runx2, COL-1 and OCN. Alizarin red staining was used for determining the ability of cell mineralization after osteogenic differentiation.Results The expressions of cell surface markers CD90 and CD105 were positive in both type of cells, while CD34, CD14 and CD45 were all negative. After 21 days of osteogenic induction, JMMSCs formed significantly more mineralized nodules than BMMSCs. After 7, 14, 21 days of osteogenic induction, JMMSCs expressed more osteogenic-related molecules than BMMSCs.Conclusion The osteogenic differentiation capacity and mineralization ability of JMMSCs are significantly higher than BMMSCs. Jaw bone might be a more suitable source of seed cells in bone tissue engineering compared with long bone.
骨髓间充质干细胞是近年来研究最为广泛的一种间充质干细胞, 并且具有自我更新的能力和多向分化的潜能[1]。其中自体来源人骨髓间充质干细胞(human bone marrow mesenchymal stem cells, hBMSCs)是组织工程和再生医学领域研究和应用的热点[2, 3], 临床上广泛应用自体骨移植来修复颌面部缺损的治疗, 尤其以颌骨作为供区移植往往能取得更高的成功率[4]。然而, 目前不能确定哪种hBMSCs成骨分化能力较强, 以及在分子水平上是否存在差异。鉴于获取长骨来源骨髓间充质干细胞(bone-marrow-derived mesenchymal stem cells, BMMSCs)对供区造成的创伤较大, 颌骨来源骨髓间充质干细胞(jaw bone-marrow-derived mesenchymal stem cells, JMMSCs)可通过正颌外科手术废弃的颌骨碎片获得[5], 在组织工程中寻找更加合适的种子细胞具有重要的意义[6, 7]。本研究通过对JMMSCs和BMMSCs的成骨分化能力, 以及分子水平上的差异进行比较, 拟为筛选及获取合适的骨组织工程干细胞提供理论支持。
志愿者长骨骨髓5 mL(广州医科大学第一附属医院); 正颌手术磨除的颌骨碎片(广州医科大学第一附属医院, 均来自20~40岁无系统性疾病健康的志愿者); α -MEM培养基、谷氨酰胺(Gibco公司, 美国)、2.5 g/L胰蛋白酶; 胎牛血清(杭州四季青公司)、β -甘油磷酸钠、地塞米松、抗坏血酸(Sigma公司, 美国); 人淋巴细胞分离液(MP Biomedicals, 美国); 茜素红(上海化学试剂采购供应站); 逆转录试剂盒、qRT-PCR 试剂盒(TaKaRa公司, 日本); 引物Runx2、1型胶原(collagen type 1, COL-1)、骨钙素(osteocalcin, OCN)、GAPDH(上海生工有限公司, 中国); Runx2、COL-1、OCN抗体(Abcam公司, 英国); 抗GAPDH鼠单克隆抗体(北京康为世纪生物科技有限公司); 山羊抗小鼠IgG、山羊抗兔IgG(中国壮志生物公司); qPCR RT Master Mix、SYBR® Premix EX Taq™ Ⅱ (Takara公司, 日本); Western Blot及IP细胞裂解液(中国碧云天公司); 二氧化碳恒温孵箱(Forma, 美国); 荧光倒置相差显微镜和照相系统(Olympus, 日本); Sunrise酶标仪(Tecan, 奥地利); FACS Aria流式细胞仪(BD, 美国); YJ-875超净工作台; 低温高速离心机(Heraeus, 德国); 凝胶电泳仪(Bio-Rad, 美国); 紫外线分光光度仪(Ependorf公司, 德国); CFX96 Real Time System 蛋白电泳仪(BioRad公司, 美国); 凝胶成像分析仪(上海培清科技有限公司)。
在正颌手术中无菌获取废弃的颌骨骨松质, 立即在超净工作台用无菌磷酸盐缓冲液反复清洗3~4次, 800 r/min离心5 min, 弃上清, 10%质量分数胎牛血清的α -MEM培养液重悬细胞, 连同剪碎的颌骨骨碎接种于25 cm2培养瓶, 置于37 ℃、5%体积分数CO2饱和湿度孵箱中培养。72 h后小心吸去培养液和未贴壁细胞进行首次换液, 每隔48 h换液1次。待细胞生长汇合达瓶底80%时, 用2.5 g/L胰酶消化细胞并按1:3比例传代, 记为P1。取对数生长期的第1代细胞, 调整细胞密度至100~150个/mL, 充分混匀并接种于直径10 cm的一次性培养皿中(3 mL/皿), 培养贴壁后标记单个细胞并补液至8 mL, 常规培养7~10 d。出现细胞克隆(细胞克隆判断标准≥ 500个细胞)后, 将克隆细胞用胰酶消化后常规传代培养, 取第3~5代细胞用于以下实验。
抽取志愿者长骨骨髓5 mL, 立即注入加有1 mL肝素的离心管, 所取骨髓用等比例磷酸盐缓冲液混匀按1:1比例用磷酸盐缓冲液稀释并置10 mL离心管中混匀, 再将稀释后的骨髓液按1:1比例缓慢加入到1.073 g/mL人淋巴细胞分离液之上, 2 000 r/min离心20 min; 离心后液体分为4层, 吸取第2层白色云雾状层, 加5 mL 磷酸盐缓冲液充分混匀清洗, 800 r/min离心5 min, 重复2次后弃上清液, 再用含10%质量分数胎牛血清α -MEM培养液重悬后接种于25 cm2培养瓶, 置于37 ℃、5%体积分数CO2饱和湿度孵箱中培养。24 h后吸去培养液和未贴壁细胞并进行首次换液, 以后每48 h换液1次。待细胞长满约80%后, 用2.5 g/L胰酶消化细胞并按1:3比例传代, 记为P1。以此类推, 取第3~5代细胞用于以下实验。
用2.5 g/L胰酶消化上述两种细胞, 磷酸盐缓冲液洗涤2次后重悬, 调整细胞密度为1 × 106个/mL, 分装至EP管中, 每管200 μ L。分别加CD90、CD105、CD34、CD14、CD45抗体2 μ L后, 4 ℃避光孵育1 h, 磷酸盐缓冲液洗涤2次后重悬, 流式细胞仪检测。
取第4代细胞以2 × 105个/mL的密度接种于6孔培养板中, 培养至贴壁细胞达80%汇合后弃原液, 加入成骨诱导液(含有地塞米松100 nM, 10%FBS的α -MEM, 维生素C 50 μ g/mL, β -甘油磷酸钠10 mM)进行诱导分化培养, 每48 h换液1次。成骨诱导分化21 d后进行茜素红染料染色, 成骨诱导分化7 d、14 d、21 d后采用qRT-PCR及21 d后Western Blot检测方法检测相关成骨基因及蛋白的表达。
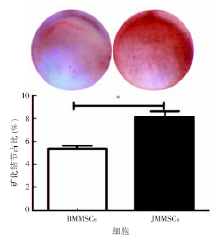
1.5.1 茜素红染色检测成骨诱导分化能力 去净培养液, 磷酸盐缓冲液清洗2次; 4%多聚甲醛5 mL 固定30 min, 磷酸盐缓冲液清洗2次, 向孔内加入10 mL 1%茜素红溶液, 常温条件下染色30 min; 吸净液体, 磷酸盐缓冲液清洗去除非特异性茜素红; 显微镜下观察并数码拍照; 每孔加入1 mL氯化十六烷吡啶, 室温放置15 min, 将溶液转移至96孔板, 150 μ L/孔, 酶联免疫检测仪在波长540 nm检测每孔吸光度值。
1.5.2 PCR检测 用2.5 g/L胰酶消化生长状态较好的骨髓干细胞, 6孔板每孔接种1 × 106个细胞, 加入2 mL含10% FBS的α -MEM培养液培养, 每48 h换液。待孔底细胞达80%~90%汇合时, 分别向两种干细胞加成骨诱导液。分别于7 d、14 d、21 d提取各组细胞RNA, qRT-PCR技术检测成骨相关基因COL-1、Runx2、OCN的表达情况。以GAPDH作为内参, CFX Manager软件对实验结果进行分析。
实时定量PCR目的基因引物序列如下。GAPDH上游引物序列:5′ -CTGCAAGAACAGCATTGCAT-3′ ; GAPDH下游引物序列:5′ -GACCACCTGGTCCTCAGTGT-3′ 。COL-1上游引物序列:5′ -AGACGAAGACATCCCACCAATC-3′ ; COL-1下游引物序列:5′ -GATCACGTCATCGCACAACAC-3′ 。Runx2上游引物序列:5′ -CCCGTGGCCTTCAAGGT-3′ ; Runx2下游引物序列:5′ -CGTTACCCGCCATGACAGTA-3′ 。OCN上游引物序列:5′ -GCCACCGAGACACCATGAGA-3′ ; OCN下游引物序列:AGGCTGCACCTTTGCTGGAC。
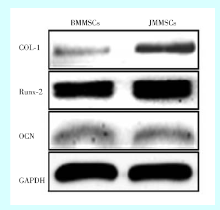
1.5.3 Western Blot检测 对蛋白抽提试剂进行预冷, 在进行蛋白抽提前2~3 min内按照1:99比例加入蛋白酶抑制剂混合物, 使蛋白酶抑制剂混合物在抽提试剂中成1 × 工作液。按照总蛋白提取试剂盒分别提取两种干细胞总蛋白, Bradford法蛋白定量后进行SDS-PAGE凝胶电泳, 继而转膜、封闭和抗体杂交, 最后进行化学显影检测。
使用SPSS 18.0软件进行数据分析, 计量资料采用均数 ± 标准差表示, 检验水平α =0.05。
流式细胞仪检测结果显示两种细胞纯度均较高。BMMSCs组CD90和CD105阳性率分别为:97.7%和73.7%, 而CD34、CD14、CD45的阳性率为1.93%、2.19%、1.98%; JMMSCs的CD90和CD105阳性率分别为99.6%和66.9%, 而CD34、CD14、CD45的阳性率仅为0.657%、0.96%、0.637%(图1)。以上结果表明两种细胞符合间充质来源的干细胞征。
在成骨诱导培养基的作用下, 随着诱导时间的延长, 两种干细胞均呈多角形, 细胞呈集落样生长, 胞质内细胞颗粒增多, 胞外基质的钙盐沉积增加, 在培养皿底壁可见不透光的白色小点, 继续诱导逐渐形成矿化结节。成骨诱导21 d后, 茜素红染色结果显示两种细胞均形成钙化结节, 结节呈红色。与BMMSCs相比, JMMSCs形成的矿化结节明显较多(图2)。定量分析数据显示JMMSCs形成的矿化结节较多(矿化结节占比8.6%, t=3.461, P=0.026)。结果说明了JMMSCs成骨分化能力较BMMSCs强。
两种干细胞成骨分化诱导7 d、14 d、21 d后行qRT-PCR检测, 与BMMSCs相比较, JMMSCs的COL-1、Runx2、OCN基因水平均显著较高, 差异具有统计学意义(P< 0.05)(图3)。结果表明, JMMSCs比BMMSCs在成骨相关分子基因水平上表达更高。
两种干细胞成骨分化诱导21 d后其成骨相关蛋白表达量, JMMSCs的COL-1蛋白表达水平明显高于BMMSCs; JMMSCs的Runx2蛋白水平表达稍高于BMMSCs; 而OCN, 两者差异不显著(图4)。
颌骨与长骨是由机体骨骼中的不同细胞发育而成, 并且两种骨组织具体成骨过程也不同, 其中颌骨是由外胚层的神经嵴细胞经软骨内成骨形成, 而长骨是由中胚层的间叶细胞经骨膜内成骨形成[9]。在骨质疏松症、甲亢等疾病及去势的小鼠模型中, 颌骨的受累程度明显小于长骨[10]。Matsubara等[11]阐明来源于大鼠颌骨的骨髓间充质干细胞其体外增殖能力明显高于来源于长骨的骨髓间充质干细胞。同时, 成骨与破骨为一对平衡, Chaichanasakul、Jiang等[12, 13]揭示大鼠的JMMSCs与BMMSCs表现出不同的促进破骨能力, 具体为颌骨中OPG与RANKL的比值较长骨的高, 这说明了JMMSCs具有显著的促进破骨细胞分化能力, 在体内有利于正确的成骨与破骨平衡调控。
本研究首先通过流式细胞仪鉴定分离的两种hBMSCs具有间充质干细胞的表型特点, 接着通过茜素红染色验证了JMMSCs成骨分化能力较BMMSCs强; 在基因及蛋白水平上, 与BMMSCs相比较, JMMSCs的Runx2、COL-1及OCN均具有较高的表达。在矿化早期, 因为干细胞的功能很大程度上由重要功能基因的转录及翻译来决定[14], 所以用qRT-PCR, western blot分别在基因和蛋白水平上对Runx2、COL-1、OCN三种分子进行检测。Runx2(runt-related transcription factor 2)蛋白在成骨细胞分化的多种信号途径中起中心作用, 是成骨细胞开始分化的标志[15]; 同时Runx2能够通过调控OSX从而在成/软骨细胞的分化调节中其重要作用[16]。COL-1是骨组织的主要有机成份, 是成骨细胞分泌的主要蛋白质[17], 是成骨细胞表型和形成矿化结节的基本保障[18]。OCN主要在成骨细胞矿化形成期出现, 是其成熟的标志之一; 在矿化早期, 细胞中OCN活性升高, 细胞分泌的矿化基质也越多[19]。本实验中两种干细胞不同时间点的分子表达检测中, Runx2、COL-1、OCN的基因表达有显著的上升, Runx2、COL-1在蛋白层面上的表达有明显升高, OCN的表达两者差异不显著。推测可能是多种因素综合作用的结果, 包括质粒不稳定、蛋白酶将蛋白降解, mRNA的不稳定性、mRNA的二级结构的复杂性, 密码子的使用频率低等。因此, 在本研究中出现了OCN的蛋白表达结果与茜素红染色结果不一致的现象。鉴于Runx2及COL-1的基因与蛋白结果, 以及茜素红染色结果, 本实验表明BMMSCs的形成矿化结节能力弱于JMMSCs, JMMSCs具有更强的矿化能力。
以上结果均说明:人体来源的JMMSCs成骨能力强于BMMSCs, 在一定条件下比BMMSCs更适用于骨组织工程的种子细胞, 可以用于骨缺失的治疗。另外, JMMSCs比BMMSCs在获取时所致的创伤要更小, 为获取种子细胞提供了便利条件。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|